研究内容紹介
分子プローブ・分子イメージング・機能分子化学・有機金属化学
研究概要
具体的には、疾病の早期発見と診断確度の向上に大きく貢献する “高次生体イメージング” を実現するため、生体内の “がん” など、特定の疾患部位にデリバリー・集積する機能と、イメージングに必要な磁気や超音波などのシグナルを発生する機能とをあわせ持つ革新的 “分子プローブ”を設計・合成し(図1)、さらに細胞・動物実験によるそれらの機能と有効性の評価に至る一連の研究を行っています。
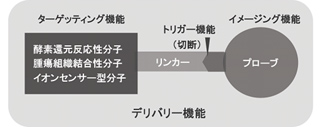
Fig. 1 分子プローブの概念図.
- 1)
- 高感度磁気共鳴イメージングのためのキラルデンドリマートリアミン配位 Gd 造影剤の合成と機能・体内動態評価
中心(コア)から規則的に分枝した高次構造を有し、単一分子量を持つ人工樹状高分子である “デンドリマー” にキラリティを導入した新しい環状トリアミン(トリアザサイクル)配位子の設計・合成を行い、それらが配位した新規 Gd-MRI 造影剤の合成に成功しました(図2)。小動物実験用 7T MRI 装置を用い、新規 Gd-MRI 造影剤の造影能を評価した結果、現在、臨床で使用されている Magnevist® より、“一桁” 高い緩和能(r 1)を示すことが明らかとなりました(NHK、共同通信、新聞各紙により全国報道。京都大学HPニュースリリース)。また、不斉点の絶対配置が全て S である造影剤の方が、絶対配置が全て R である造影剤より高い血中滞留性を示すことを、水晶振動子マイクロバランス(QCM)法による微量質量計測、および 7T MRI 装置を用いる in vivo での動物実験(血管造影など)により明らかにしました。
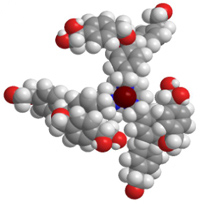
Fig. 2 新規キラルデンドリマートリアミン配位 Gd-MRI 造影剤.
- 2)
- 光超音波-磁気共鳴デュアルイメージングプローブの開発と機能評価
光超音波(Photoacoustic、PA)イメージングは、次世代の画像診断法として期待されており、近藤研究室では、この光超音波(PA)イメージングと従来の磁気共鳴(MR)イメージングを同時に可能とする PA-MR デュアルイメージングプローブの開発に取り組んでいます。具体的には、生体適合性に優れたゼラチンを用いる表面修飾により、粒径を制御した Gd2O3 ナノ粒子の高効率合成に成功し、PA-MR デュアルイメージングプローブとしての有用性を明らかにしました(図3)。
本手法は、他の常磁性金属酸化物ナノ粒子の合成にも応用可能であり、現在、糖やポリエチレングリコール(PEG)を表面修飾剤とする MnO および CoO ナノ粒子の高効率合成法の開発とそれらの機能評価に取り組んでいます。
本研究では、蛍光色素や金ナノ粒子を用いることなく、常磁性金属酸化物のみからなる安全な PA-MR デュアルイメージングプローブを開発し、独立した二種類の画像構築による疾病の早期発見と診断確度の向上を目指しています。

Fig. 3 a)ゼラチン修飾 Gd2O3 ナノ粒子のマウス皮下投与後の光超音波画像.
b)ゼラチン修飾 Gd2O3 ナノ粒子水分散液の MRI 画像.
- 3)
- 多機能分子プローブの生体内デリバリーシステムの構築
一般に、生体内に投与された化合物は、肝臓や貪食細胞による代謝、および腎糸球体での濾過により、速やかに体外へ排出されます。従って、薬剤や標識化合物といった長期間体内で作用させる必要がある物質は、特定部位(腫瘍細胞等)に存在する環境(pH や酵素濃度、表面抗原、糖鎖構造等)を検知できるターゲティング部位を持たせる技術が必要となります。これらはドラッグデリバリーシステム(DDS)と呼ばれ、分子プローブに適用することで、腫瘍などの特定部位への集積効率の向上や血中滞留性の向上が期待されます(図4)。低毒性で高感度な分子プローブや診断薬を DDS 化することにより、新たな生物学的知見を得るツールとしての新規多機能分子イメージングプローブの創製を目指し、研究を進めています。
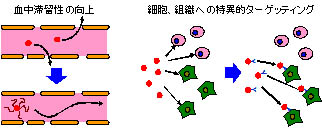
Fig. 4 DDS 化による分子プローブの生体内動態制御イメージ.
- 4)
- 多重共鳴 NMR 法を応用した革新的分子標的MRI法の開発
(白川教授、杤尾准教授(分子工学専攻)、松田教授(情報学研究科)、
青山教授(京大名誉教授)、山東教授(東大)との共同研究)
近藤研究室では、これまでタンパク質の構造解析に広く用いられてきた多重共鳴 NMR 法を応用した次世代の磁気共鳴イメージング(MRI)法の開発を行っています。多重共鳴 NMR 法は、1H 核の磁気共鳴シグナルを、隣接する NMR 活性な核(13C 核や 15N 核)へと磁化移動(シグナル情報の移動)させ、さらにその磁化を戻し、最終的に 1H 核のシグナルを検出する方法であり、分子内における特定の結合(例えば 1H-13C-15N 結合の 1H のみ)を観測する手法です。近藤研究室では、本手法を応用した “分子標的 MRI 法” を実現する “安定同位元素ラベル化プローブ” として、細胞膜脂質の一部であるホスホリルコリン骨格を 13C 核と 15N 核で標識したホスホリルコリンポリマー(13C/15N-PMPC)プローブを開発し、担癌マウスに投与した結果、13C/15N-PMPC プローブが集積した腫瘍部位のみの高選択的画像化に成功しました。また、本プローブは、肝臓、腎臓、脳などの一般の臓器には集積しないことを明らかにしています(図5、日本経済新聞により全国報道。京都大学HPニュースリリース)。このように、腫瘍部位にのみ高選択的に集積する安定同位元素ラベル化プローブを用いる “分子標的MRI法” は、PET法に匹敵する感度と選択性を有すると同時に、PET法とは異なり、被曝ゼロで数ミリ~の癌の早期診断と繰り返し検査が可能な次世代の画像診断法であり、今後の医療分野にイノベーションをもたらす起爆剤となることを期待しています。
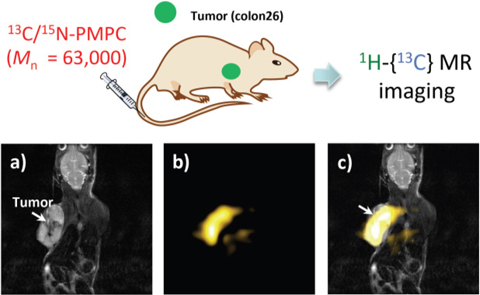
Fig. 5 13C/15N-PMPCプローブを投与したマウスの in vivo MRI 画像化.
a)従来の1H MRI 画像(T2強調画像). b)分子標的 MRI 画像(1H-{13C} 二重共鳴 MRI 画像). c)画像 a) と画像 b) の重ね合わせ.
- 1)
- ルテニウム錯体触媒に特徴的な3種のアルケンの高選択的鎖状共三量化反応の開発
有機金属化学を基盤とする新しい触媒的有機合成反応の開発は、有機合成化学における重要な研究課題であり、汎用性の高い触媒反応は、分子プローブ合成などの精密合成の重要なツールとなります。例えば、上述したキラルデンドリマートリアミン配位子の合成には、2001年ノーベル化学賞を受賞した K. Barry Sharpless 教授が開発したオスミウム触媒を用いるアルケンの不斉ジヒドロキシル化反応(Asymmetric Dihydroxylation、AD 反応)を利用しています。
近藤研究室では、“ルテニウム錯体触媒” に関する研究で世界をリードしており、例えば、独自に開発した0価ルテニウム錯体 Ru(η6-1,3,5- cyclooctatriene)(η2-dimethyl fumarate)2 を触媒として用いることにより、電子状態の少しずつ異なる3種のアルケン(N-ビニルアミド、アクリル酸誘導体、およびエチレン)の識別が可能となり、高位置および立体選択的な鎖状共三量化反応が進行することを見出しました(図6)。本研究成果は、独科学誌 Angewandte Chemie International Edition に掲載され、その表紙として採用されました。また、国内でも新聞各紙で広く報道され、その概要は、京都大学HPニュースリリースに掲載されています。
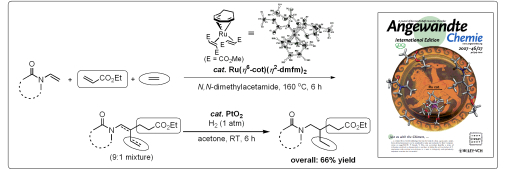
Fig 6. ルテニウム錯体触媒を用いる3種のアルケンの高選択的鎖状共三量化反応.
- 2)
- 酸素架橋ルテニウム4核錯体の合成、単結晶X線構造解析、および触媒機能の解明
有機金属錯体触媒による水の活性化を目的として、Ru(η6-1,3,5- cyclooctatriene)(η2-dimethylfumarate)2 錯体と水との反応を行った結果、酸素原子が架橋した新しいルテニウム4核錯体が高収率で得られ、その構造を単結晶X線構造解析により明らかにしました。さらに、本ルテニウム4核錯体が、“空気” を酸化剤とするアルコールのアルデヒドあるいはケトンへの高選択的酸化反応に高い触媒活性を示すことを見出しました。本反応の副生成物は水のみであり、重金属酸化物や過酸といった強い酸化剤を必要としないことから、本反応は、環境に調和したクリーンなアルコール酸化反応です(図7)。
最近では、オキソ架橋ルテニウム4核錯体が、2-アミノフェネチルアルコール類の分子内脱水素 N-複素環化反応に高い触媒活性を示すことを見出し、種々の生理活性物質の基本骨格として有用なインドール環の高効率構築法の開発に成功しました。
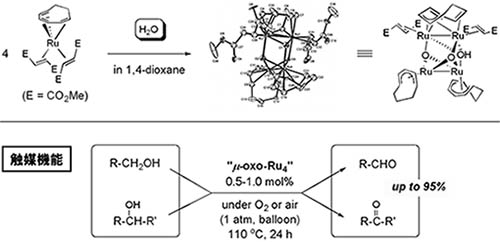
Fig 7. オキソ架橋ルテニウム4核錯体の合成と触媒機能.
- 3)
- ルテニウム錯体触媒を用いるイソシアナート、アルキンおよび一酸化炭素の分子間
[2 + 2 + 1] 共付加環化反応の開発
近藤研究室では、ルテニウム金属を環内に含む “ルテナサイクル” を鍵中間体とする機能性複素環化合物の新合成法の開発を行っており、例えば、Ru3(CO)12 触媒を用いることにより、イソシアナート、アルキンおよび一酸化炭素の分子間 [2 + 2 + 1] 共付加環化反応が良好に進行し、透明耐熱性樹脂や核酸修飾剤などの重要な基本骨格であるマレイミド誘導体のワンポットでの高効率合成法の開発に成功しています(図8)。また、本触媒反応には、一連のヘテロクムレンが利用可能であり、ケテン類を原料とする 2-フラノン誘導体、およびカルボジイミド類を原料とするアゾリノン誘導体のワンポットでの高効率合成が可能となりました。
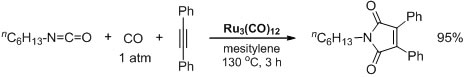
Fig 8. Ru3(CO)12 触媒を用いるイソシアナート、アルキン
および一酸化炭素の分子間[2 + 2 + 1] 共付加環化反応.



